Kintor va avanti. Risultati della sperimentazione di fase 3 di Kintor Pharmaceutical per KX-826 e GT20029.
L’annuncio
Kintor Pharmaceutical ha recentemente annunciato di aver ingaggiato il primo partecipante al suo “Pivotal Clinical Trial”. Si tratta di uno studio di Fase 2/3 in cui gli uomini affetti da alopecia androgenetica saranno trattati per 24 settimane con il veicolo di controllo, lo 0,5% o l’1% topico. Lo studio sarà condotto in Cina, con 222 pazienti per ciascun gruppo (666 pazienti in totale).
Il comunicato stampa annuncia anche un aggiornamento dello studio di Fase 3 di 52 settimane, “Long-term Safety Clinical Trial”, che ha completato il reclutamento nel Luglio 2023. I partecipanti sono stati trattati con la tintura allo 0,5% due volte al giorno.
Kintor ha reso pubblici i risultati della fase 3 per KX-826 al dosaggio dello 0,5%. Ora si sperimenterà il dosaggio all’1,0%. Un nuovo aggiornamento sulla sperimentazione di fase 3 di KX-826 (pirilutamide) da parte di Kintor che non è ancora presente sul suo sito web.
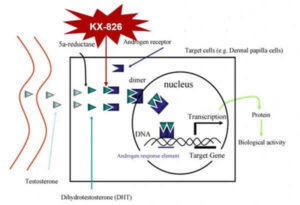
Kintor Pharmaceutical Pyrilutamide (KX-826) antagonista del recettore degli androgeni.
Risultati della sperimentazione
Non sono stati segnalati eventi avversi gravi, il più comune dei quali è stato un lieve prurito nel sito di applicazione.
Dopo 12, 24, 36 e 52 settimane di trattamento, la conta dei capelli dell’area bersaglio (TAHC) e la larghezza dei capelli non vellus dell’area bersaglio (TAHW) sono aumentate rispetto al basale:
TAHC è aumentato rispettivamente del 9,5%, 13%, 11,4% e 9,7%.
La TAHW è aumentata rispettivamente del 12,1%, 18,6%, 15,7% e 10% (un aumento statisticamente significativo rispetto al basale).
Alla settimana 24, il 60,2% dei partecipanti ha registrato una variazione di TAHC ≥10 capelli/cm2 rispetto al basale, il 28,9% una variazione ≥20 capelli/cm2 e il 18% una variazione ≥30 capelli/cm2.
Alla settimana 52, il 48,4% dei partecipanti aveva una variazione di TAHC ≥10 capelli/cm2 rispetto al basale, il 20,4% aveva una variazione ≥20 capelli/cm2 e l’11,8% aveva una variazione ≥30 capelli/cm2.
La crescita dei capelli è stata valutata soggettivamente dagli sperimentatori:
Il 60,9%, 69,5%, 64% e 54% dei partecipanti ha mostrato un miglioramento della crescita dei capelli rispetto al basale, rispettivamente a 12, 24, 36 e 52 settimane.
K-826 (pyrilutamide) è già disponibile in rete come prodotto di Koshine Biomedica (Kintor Ph.).
Riflessioni
Sebbene i risultati appaiano promettenti, ci sono diversi potenziali problemi da considerare:
Lo studio non aveva un placebo o un gruppo di controllo.
I miglioramenti di TAHC e TAHW hanno raggiunto un picco a 24 settimane e poi sono diminuiti, sollevando dubbi sull’efficacia a lungo termine.
Anche la percentuale di pazienti che hanno ottenuto miglioramenti ≥10, ≥20 e ≥30 capelli/cm² è diminuita da 24 a 52 settimane. È difficile determinare il significato clinico degli aumenti percentuali senza conoscere i dati di base.
Kintor lancia cosmetici con KX-826 come ingrediente principale
Kintor Pharmaceutical ha ufficialmente lanciato una linea di cosmetici con KX-826 come ingrediente principale. Si tratta del secondo prodotto per la perdita dei capelli che è stato lanciato negli ultimi due anni come cosmeceutico (il primo è stato CosmeRNA).
CosmeRNA è il primo prodotto biotech uscito come cosmetico.
KX-826 riceve la designazione di cosmetico INCI
KX-826 (pirilutamide) di Kintor Pharmaceutical ha ricevuto l’approvazione dell’International Nomenclature Cosmetic Ingredient (INCI) dall’International Cosmetic Ingredient Nomenclature Committee. Il nome INCI assegnato è Methylpyridinyl Fluoromethoxybenzonitrile Dimethyloxothiooxoimidazolidine.
I nomi INCI sono riconosciuti in tutto il mondo per l’identificazione degli ingredienti cosmetici.
Kintor Pharmaceutical è una società in rapida evoluzione e ben finanziata che sta conducendo studi di Fase 2 e Fase 3 negli Stati Uniti e in Cina per entrambi i suoi prodotti contro l’alopecia androgenetica maschile (AGA). Kintor sta conducendo studi sulla perdita di capelli per due distinti prodotti mirati al recettore degli androgeni (AR): un degradatore (GT20029) e un antagonista (KX-826, alias pirilutamide).
Ciascuna di queste sperimentazioni è in corso sia in Cina che negli Stati Uniti.
Ognuno di questi prodotti viene testato sia per i maschi che per le femmine affetti da alopecia androgenetica.
Il degradatore GT20029
Il prodotto GT20029 è un degradatore del recettore degli androgeni. È stato sviluppato utilizzando la piattaforma proprietaria Proteolysis Targeting Chimera (PROTAC) di Kintor.
Si tratta del primo composto topico al mondo per il recettore degli androgeni (AR) a entrare in sperimentazione clinica. GT20029 degrada la proteina AR attraverso la via dell’ubiquitina ligasi E3. Durante gli studi preclinici, GT20029 non ha causato effetti collaterali degni di nota o accumulo sistemico del farmaco.
Kintor Pharmaceutical ha annunciato che lo studio clinico di Fase 2 in Cina del suo composto GT20029, il primo della classe per il trattamento dell’alopecia androgenetica, mirato alla proteolisi del recettore degli androgeni (AR), ha raggiunto l’endpoint primario. I risultati sono statisticamente significativi e clinicamente significativi, mentre la sicurezza e la tollerabilità sono buone.
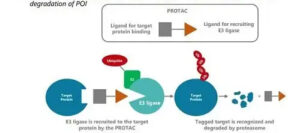
Kintor GT20029 degradatore del recettore degli androgeni.
GT20029 ha dimostrato un’efficacia statisticamente significativa rispetto al placebo sia nella coorte di dosaggio QD (una volta al giorno) che in quella BIW (due volte alla settimana).
Dopo 12 settimane di trattamento, il gruppo GT20029 0,5% QD ha mostrato un aumento di 16,80 capelli/cm² rispetto al basale. Si tratta di un aumento di 6,69 capelli/cm² rispetto al gruppo placebo.
La conta dei capelli totali dell’area target (TAHC) del gruppo GT20029 1,0% BIW ha mostrato un aumento di 11,94 capelli/cm² rispetto al basale. Si tratta di un aumento di 7,36 capelli/cm² rispetto al placebo.
Il dosaggio di GT20029 all’1% di BIW è stato identificato come il livello di dosaggio ottimale ed è stato raccomandato per lo studio clinico di fase III in Cina.
Citazione chiave:
“Sulla base dei risultati dello studio clinico di fase 2, l’azienda metterà in atto strategie cliniche successive per GT20029, come l’avvio di uno studio clinico di fase III in Cina e di uno studio clinico di fase 2 negli Stati Uniti per l’AGA maschile”.
Articolo tratto, tradotto e adattato da folliclethought.com e da hairlosscure2020.com
PRODOTTI CORRELATI
Cerchi un siero di cellule staminali che possa aiutare ad aumentare la crescita dei capelli e fermare immediatamente la caduta? Ottieni il siero CALECIM®, con derma stamp omaggio!
Vitaminity DHT Blocker Complex integratore anti DHT contro la caduta dei capelli a base dei migliori estratti vegetali e componenti
APPROFONDIMENTI