I BCAA sono precursori della glutammina perchè non soggetti al “rapimento” ad opera degli enterocitri intestinali e del sistema immunitario, giungono rapidamente nel tessuto muscolare dove possono essere impiegati come sub-strato nella sintesi di glucosio preservando la glutammina stessa da questo processo, oppure per sintetizzare rapidamente nuova glutammina.
Va fatta un pò di chiarezza sulla Glutammina e ci perdo un pò di tempo:
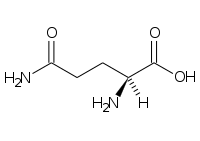
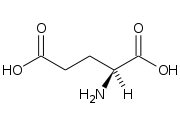
La glutammina (abbreviabile con “Gln” e “Q”), o meglio “5-ammide dell'acido 2 -ammino-1,5-pentandioico” è a tutti gli effetti l’ammide del glutammato: infatti la sua catena laterale è un ammide costituita dalla sostituzione della catena laterale di glutammato con un gruppo funzionale dell’ammina.
La sua formula molecolare è: C5H10N2O3
Le fonti proteiche di origine animale sono relativamente povere di glutammina, arrivando a un massimo di 5-8% rappresentato dalla caseina. Al contrario molte fonti proteiche vegetali ne possiedono un contenuto elevato, e fra tutte spiccano le proteine del grano che possono superare il 30% del contenuto proteico totale (in forma idrolizzata, vi si ricava glutammina peptidica da impiegare come integratore). Le proteine animali apportano principalmente un’altro amminoacido: l'acido glutammico.
L'acido glutammico o glutammato (Glu o E) può seguire diverse vie metaboliche e, tra le altre, può essere convertito in glutammina degli enzimi glutammina sintentasi e glutaminase.

Questa reazione avviene frequentemente nelle cellule ed è di notevole importanza in quanto fa parte del sistema di trasporto dell’ammoniaca che, in forma legata, perde la sua citotossicità. Come vedete si tratta comunque di un processo reversibile e che permette la risintesi dell'acido glutammico a partire dalla glutammina, ciò avviene principalmente all’interno di fegato e cervello. All’interno del tessuto muscolare la glutammina viene principalmente sintetizzata a partire dagli amminoacidi arginina, ornitina e prolina, ma in caso di bisogno anche i BCAA leucina, valina e isoleucina (con un contributo maggiore della prima) possono essere impiegati nel processo di sintesi. In sintesi possiamo dire che nel corpo umano sono vari i siti in cui può essere sintetizzata la glutammina e, nonostante il principale rimangano i muscoli, ciò può avvenire anche all’interno di polmoni, fegato, cervello e, perfino, adipe, ed è in grado di produrrne un quantitativo che oscilla dai 50 ai 120g al giorno, quantitativo che, come vedremo, in varie situazioni non è sufficente a coprirne il fabbisogno.
RUOLO FISIOLOGICO
Sembra incredibile come una sostanza considerata non essenziale, in quanto sintetizzabile a partire da altre, possa essere tanto abbondante e indispensabile nell’organismo. Si tratta, infatti, di un amminoacido dalla presenza imponente, basti pensare che da solo rappresenta il 65% del contenuto di amminoacidi all’interno del muscolo (che è anche la sede principale della sua biosintesi) dove la sua concentrazzione si aggira approssimatamente intorno alle 35 mmol/l, ma si trova in abbondanza anche in altri organi quali reni, reni e midollo spinale. Inoltre vanta una abbondante presenza all’interno del plasma sanguigno, circa il 20% del contenuto totale di amminoacidi (ovvero circa 500-900 µmol/l di sangue), e nel liquido cefalorachidiano.
In ogniuna di queste sedi svolge ruoli di grande importanza, direttamente o come precursore di altre molecole. Cerchiamo, ora, di vedere almeno le sue principali funzioni all’interno di organi e apparati.
INTESTINO
La glutammina è impiegata come principale substrato energetico dagli enterociti: le cellule che compongono le pareti intestinali. Gli enterociti si distaccano circa ogni tre giorni ed è necessario, quindi, un apporto di glutammina per poterle sostituire. Le ricerche hanno dimsotrato come circa il 40% della glutammina totale impiegata dall’organismo viene spesa per la sintesi e la sostituizione delle cellule gastrointestinali. Certo è vero che questo continuo fabbisogno di glutammina delle cellule intestinali arriva a consumare fino all’85% di una dose, e questo e certamente il principale problema delle assunzioni orali, ma non dobbiamo scordare che questo processo è vitale per preservare l’integrità delle cellule sulle pareti viscerali.
RENI
A seguito di attività fisica è normale riscontrare un’elevata acididosi metabolica, derivante da un incremento degli acidi organici come scorie azotate e i chetoni, prodottidi scarto delle reazioni metaboliche indotte dall’esercizio fisico. La glutammina viene scomposta nei reni e convertita in ammoniaca che a sua volta si converte in ammonio, uno ione che tampona i livelli elevati di ione idrogeno indotti dall’attività fisica. Ma non solo l’attività fisica porta a un maggiore consumo di glutammina da parte dei reni: l’alimentazione influenza questo processo, forse, in misura persino maggiore. I ricercatori hanno, paradossalmente, riscontrato come i livelli ematici e muscolari di glutammina più bassi possano essere riscontrati in bodybuilding e powerlifting piuttosto che in praticanti di altri sport come nuotatori e ciclisti. Ciò è certamente correlato alla maggiore assunzione alimentare di proteine che tende a indurre livelli più bassi di glutammina a causa dell’aumentata acidità indotta dalle diete iperproteiche. Ciò può essere ulteriormente aggravato in regimi alimentari che abbinano a un quantitativo alto di proteine, una elevata percentuale di grassi, dato che acidi grassi liberi e corpi chetonici aumentano ulteriormente l’acidosi metabolica. La glutammina rappresenta anche il sub-strato preferito per il processo di gluconeogenesi nei reni, seeguita dall’alanina (gli altri vengono, invece, convertiti principalmente nel fegato. Può essere riconvertita in #945;-ketoglutarato e, quindi, essere sfruttata a fini energetici nel ciclo di Krebs (o dell’acido citrico)
FEGATO E SISTEMA IMMUNITARIO
La Glutammina è il combustibile preferito dalle delle cellune del sisema immunitario, essa è direttamente coinvolota nella nucleogenesi di cellule a proliferazione rapida e, in quanto donatore degli atomi di azoto 3 e 9 del nucleo purinico, può contribuire a una migliore produzione di globuli bianchi. Svariate ricerche indicano come l’aumento della disponibilità orale di Glutammina può effettivamente migliorare le risposte immunitarie che implicano le citokine che originano dai macrofagi o dalle cellule T sintetizzate nel timo (da cui appunto la lettare T). In particolare la Glutammina si è dimostrata la sostanza principalmente coinvolta nella stimolazione di monociti e macrofagi, nonchè degli epatociti prodotti dal fegato. Al loro volta queste cellule rilasciano mediatori infiammatori come l’interleucina-1, l’interleucina-6 e il fattore alfa di necrosi tumorale. A riprova del suo ruolo durante i processi infettivi e infiammatori vi sono in letteratura riferimenti a sue alterazioni in pazienti chirurgici gravi (in particolare ustionati gravi), affetti da immuno-deficenza causata da infezioni virali o alterazioni ormonali (in particolare aumento di ormoni tiroidei). Nonchè naturalmente in atleti sottoposti a esercizio fisico strenuo e prolungato e quindi a rischio di infezioni. In ogniuno di questi casi si è riscontrato un maggiore consumo di glutammina muscolare, e un miglioramento della risposta pro-infettiva/infiammatori quando questa era supplementata. La glutammina, come abbiamo visto, può essere sisnetizzata a partire dal'acido glutammico con l’ammoniaca e l’organismo è in grado di invertire il processo riformando il glutammato al bisogno. Questo amminoa